S5 Aineiden ominaisuudet ja rakenne
Tutkitaan monipuolisesti seosten ja puhtaiden aineiden ominaisuuksia kuten vesi- ja rasvaliukoisuutta. Alkuaineiden ominaisuuksien pohjalta tutustutaan aineen koostumiseen atomeista, atomin rakenteeseen ja jaksolliseen järjestelmään. Malleja ja simulaatioita käytetään yhdisteiden rakentumisen hahmottamisessa. Tutustutaan hiileen, sen yhdisteisiin ja ravintoaineisiin. Perehdytään johonkin orgaaniseen yhdisteryhmään.
Aiheet
[muokkaa | muokkaa wikitekstiä]Mitä kemia on?
[muokkaa | muokkaa wikitekstiä]Kemian mikromaailma
[muokkaa | muokkaa wikitekstiä]Tässä osassa tutustutaan kemian mikromaailmaan tai oikeastaan paremminkin nanomaailmaan. Nanometri on metrin miljardisosa, eikä tässä mittaluokassa tapahtuvia ilmiöitä tai rakenteita voida tutkia perusmikroskoopilla.
Asioista keskusteleminen ilman näkemistä on hankalaa. Tämän vuoksi kemian opinnoissa käytetään paljon erilaisia malleja kuvaamaan vaikkapa molekyylien tai atomien rakenteita. Mallit ovat aina yksinkertaistuksia, eivätkä vastaa täysin todellisuutta, mutta nanomaailmaa selitettäessä erilaisiin malleihin turvaudutaan vielä yliopistossakin.
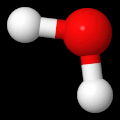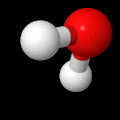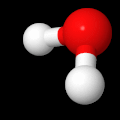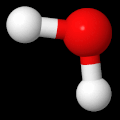
Jo peruskoulussa sama asia, vaikkapa vesimolekyyli, voidaan kuvata useilla erilaisilla malleilla. Kaikissa eri malleissa on jokin etu toiseen verrattuna ja tämän vuoksi yhden ainoan esitystavan käyttö ei ole järkevää. Alla on esitetty kolme erilaista mallia samasta vesimolekyylistä. Kaikissa näissä malleissa on on omat hyvät ja huonot puolensa. Tämän vuoksi erilaisten toisiaan täydentävien mallien käyttö on tärkeää.
-
Pallotikkumalli vesimolekyylistä
-
Kalottimalli vesimolekyylistä
-
Pallotikkumalli, jossa on esitetty varausten jakautuminen vesimolekyylissä
Katso Opetus.tv sivuilta video: Kemian mikromaailma http://opetus.tv/ylakoulu/kemian-mikromaailma/
H01 Kemian mikromaailma
[muokkaa | muokkaa wikitekstiä]- Mitä tarkoittaa nanometri? (metrin miljardisosa, 0,000 000 001 m)
- Laita käsitteet järjestykseen isoimmasta pienimpään: molekyyli, solu, atomi (solu, molekyyli, atomi)
- Mistä perusyksiköistä molekyylit koostuvat? (atomeista)
A01 Kemian mikromaailma
[muokkaa | muokkaa wikitekstiä]| Tunnus |
H |
|---|---|
| Järjestysluku |
1 |
| Massa |
1,008 atomimassayksikkö |
|---|---|
| Väri |
Väritön (d) |
| Tiheys |
0,09 grammaa per kuutiosenttimetri |
| Löytövuosi | |
|---|---|
| Löytäjä |
Henry Cavendish (en) |
| Tunnus |
O |
|---|---|
| Järjestysluku |
8 |
| Massa |
15,999 atomimassayksikkö |
|---|
| Löytövuosi | |
|---|---|
| Löytäjä |
Carl Wilhelm Scheele (en) |
- Mistä atomeista vesimolekyyli koostuu? (kahdesta vety- ja yhdestä happiatomista)
- Miksi atomeista ja molekyyleistä on olemassa erilaisia malleja? (Mallinnus on tärkeä osa luonnontieteitä. Mallit eivät kuitenkaan koskaan vastaa täysin todellisuutta, vaan ovat yksinkertaistuksia siitä. Erilaisten mallien avulla kemistit voivat selittää ilmiöitä paremmin kuin pelkkiä numeroita käyttämällä.)
Aine
[muokkaa | muokkaa wikitekstiä]Kemia tutkii ainetta ja aineen rakennetta. Tässä kappaleessa tutustutaan yhteen tapaan jaotella aineita omiin luokkiin, ja samalla opitaan useita kemian peruskäsitteitä. Tekstissä ja videossa kohdataan mm. seuraavat käsitteet: homogeeninen, heterogeeninen, alkuaine, yhdiste ja seos.
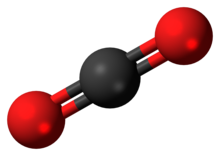
Ilma on hyvä esimerkki homogeenisesta (tasakoosteinen) seoksesta. Ilma jota hengitämme on kaasuseos, josta suurin osa on passiivista eli reagoimatonta - tai inerttiä, kuten kemisti sanoisi - typpikaasua. Typen osuus ilmasta on noin 78 prosenttia. Happikaasun osuus ilmasta on noin 21 prosenttia. Näiden kahden kaasun prosenttiosuudet yhteenlaskemalla huomataan, että ilmasta noin 99 prosenttia on hapen ja typen seosta. Jäljelle jäävä yksi prosentti ilmasta koostuu lukuisista muista kaasuista, kuten argonista ja hiilidioksidista. Vaikka hiilidioksidin prosenttiosuus ilmasta on alle 0,04 prosenttia, on se elämän kannalta välttämätön kaasu. Kasvit ottavat ilmasta hiilidioksidia yhteyttämisreaktioon ja reaktiotuotteena ilmaan vapautuu happea.
Tällä kurssilla puhutaan paljon myös vedestä ja tällöin tarkoitetaan kemiallisesti katsoen puhdasta vettä (H2O). Arkikielessä käytämme myös ilmaisua puhdas vesi, mutta tällä emme tarkoita kemiallisesti puhdasta vettä. Arkikielen puhtaalla vedellä tarkoitamme yleensä juomakelpoista vettä. Kemiallisesti katsoen juomavesi on kuitenkin kaikkea muuta kuin puhdasta, sillä luonnosta löytyvään tai hanasta tulevaan veteen on aina liuenneena erilaisia yhdisteitä. Kemiallisesti puhdas vesi on täysin mautonta. Arkikielessä kemiallisesti puhdasta vettä kutsutaan yleensä akkuvedeksi tai tislatuksi vedeksi. Akkuvettä käytetään mm. silitysrautoihin tai auton akkuihin ja sitä voi ostaa huoltoasemilta.

Juotava vesi (vesijohtovesi) on ilman tavoin kemiallisessa mielessä homogeeninen seos. Vesijohtovesi on esimerkki nestemäisestä homogeenisesta seoksesta ja ilma kaasumaisesta. Homogeeninen seos voi olla näiden lisäksi myös kiinteää. Esimerkkeinä kiinteistä homogeenisista seoksista mainittakoon messinki [kuparin (Cu) ja sinkin (Zn) seos] ja pronssi [kuparin (Cu) ja tinan (Sn) seos]. Metalliseoksiin eli lejeerinkeihin tutustutaan tarkemmin kurssilla kaksi.

![]() Katso Opetus.tv:n sivuilta video: Aine http://opetus.tv/ylakoulu/kemian-mikromaailma/aine/
Katso Opetus.tv:n sivuilta video: Aine http://opetus.tv/ylakoulu/kemian-mikromaailma/aine/
H01 Aine
[muokkaa | muokkaa wikitekstiä]- Mitä tarkoittaa homogeeninen? (Homogeeninen tarkoittaa tasakoosteista seosta. Homogeenisessä seoksessa olevia aineita ei voi erottaa silmällä toisistaan)
- Mitä tarkoittaa heterogeeninen? (Heterogeeninen tarkoittaa sekakoosteista. Heterogeenisessa seoksessa olevat eri osat voidaan erottaa silmillä. Hernekeitto on esimerkki heterogeenisesta seoksesta. Keitosta erottaa, että se koostuu useista eri osista.)
- Mitä tarkoittaa lejeerinki? (Lejeerinki tarkoittaa samaa kuin metalliseos.)
- Minkä kahden alkuaineen seos mm. patsaissa käytettävä pronssi on? (kupari ja tina)
- Ilma on kaasujen seos. Mitä kahta kaasua on eniten raikkaassa ulkoilmassa? (typpeä ja happea)
A02 Aine
[muokkaa | muokkaa wikitekstiä]- Tutki tuoteselosteita ja kerro minkä nimisiä aineita kaupassa myytävään pullotettuun veteen on liuenneena. (Liuenneena mm. natrium, rauta, kalsium, kloridi, fluoridi, sulfaatti, nitraatti)
- Mitä tarkoitetaan kemiallisella yhdisteellä? (Yhdiste koostuu vähintään kahdesta erilaisesta yhteenliittyneestä atomista)
- Anna esimerkki yhdisteestä. (vesi, hiilidioksidi, sokeri).
- Anna esimerkki homogeenisesta seoksesta. (esim. ilma, pullovesi, lähdevesi)
- Maitopurkissa sanotaan, että tuote on homogenoitu. Mitä tämä tarkoittaa? Etsi tieto verkosta. (Heterogeenista maitoa on käsitelty siten, että on saatu tasakoosteinen tuote, jossa rasva ei enää erotu pinnalle)
Kemialliset merkit
[muokkaa | muokkaa wikitekstiä]Kemiassa puhutaan paljon alkuaineista. Alkuaineita on noin sata erilaista. Selkeyden vuoksi on kansainvälisesti sovittu, että kaikissa maissa alkuaineiden kemialliset merkit ilmaistaan samalla tavalla. Näin kemian merkkikieli on sama riippumatta siitä millä kielellä asian haluat opiskella. On kuitenkin huomioitava, että alkuaineiden nimet voivat olla eri kielissä hyvinkin erilaisia. Happi on englanniksi oxygen (O) ja vety hydrogen (H). Monesti alkuaineen symbolin muistamisessa auttaa, kun muistaa mikä on aineen englanninkielinen nimi.
Kurssin ensimmäisellä sivulla (1.1. Kemian mikromaailma) puhuttiin erilaisista atomi- ja molekyylimalleista, joita kemistit käyttävät. Myös jaksollisesta järjestelmästä on olemassa lukuisia erilaisia versioita. Voit tutkia asiaa etsimällä kuvia hakusanalla Periodic table of elements (jaksollinen järjestelmä). Usein järjestelmästä erotellaan jonkin määritelmän mukaan samankaltaisia aineita, kuten yläpuolella esitetystä järjestelmästä nähdään. (Värien selityksiä ei käydä vielä tässä vaiheessa läpi.)

Tässä jaksollisessä järjestelmässä värikoodeilla on erotettu metallit, puolimetallit ja epämetallit. Järjestelmästä huomataan, että suurin osa alkuaineista on metalleja (noin ⅔). Kaikilla metalleilla on niille yhteisiä ominaisuuksi, kuten hyvä sähkön- ja lämmönjohtokyky. Metallien ominaisuuksiin palataan tarkemmin kurssilla kaksi.
Tunnetuimpia puolimetalleja ovat pii (Si, engl. silicon) ja boori (B). Puolimetallit ovat ns. puolijohteita ja tämän vuoksi tärkeitä elektroniikkateollisuudelle (vrt. Piilaakso).
Epämetalleista voidaan tässä vaiheessa tehdä huomio, että vesimolekyylin vety (H) ja happi (O) ovat molemmat epämetalleja. Epämetallien liittyessä yhteen muodostuukin molekyylejä.
![]() Katso Opetus.tv:n sivuilta video: Kemialliset merkit
Katso Opetus.tv:n sivuilta video: Kemialliset merkit
Tutustu interaktiiviseen alkuaineiden jaksolliseen järjestelmään Ptable.com sivustolla (englanniksi)
H03 Kemialliset merkit
[muokkaa | muokkaa wikitekstiä]- Anna kemialliset merkit seuraaville alkuaineille: vety, happi, typpi, rikki, natrium, elohopea, pii. (H, O, N, S, Na, Hg, Si)
- Mitä alkuainetta seuraavat kemialliset merkit tarkoittavat: Au, Cu, Hg, Zn, Li (kulta, kupari, elohopea, sinkki, litium)
- Järjestele tehtävän yksi alkuaineet metalleihin, epämetalleihin ja puolimetalleihin. (Metallit: Na, Hg; Epämetallit: H, O, N, S; Puolimetallit: Si)
A03 Kemialliset merkit
[muokkaa | muokkaa wikitekstiä]- Mainitse viisi epämetallia ja viisi metallia. Nimeä alkuaineet ja ilmoita niiden kemiallinen merkki. (Metallit: esim. Au, Ag, Ni, Zn, Fe ja Epämetallit: esim. N, P, H, O, Cl)
- Tutustu Helsingin Sanomien juttusarjaan alkuaineista. Valitse alkuaineiden joukosta kaksi, joihin tutustut tarkemmin. Kerro lyhyesti ja omin sanoin näiden kahden alkuaineen historiasta.
- Tutustu wikipedia-artikkeliin ilotulitteista. Mitä alkuaineita ilotulitteissa yleisesti käytetään ja miksi? (mm. magnesium, Mg ja Litium, Li. Eri alkuaineilla saadaan aikaan erilaisia värejä.)
Alkuaine, yhdiste ja molekyyli
[muokkaa | muokkaa wikitekstiä]| Tunnus |
C |
|---|---|
| Järjestysluku |
6 |
| Massa |
12,011 atomimassayksikkö |
|---|---|
| Tiheys |
2,26 grammaa per kuutiosenttimetri, 3,51 grammaa per kuutiosenttimetri |
| Löytövuosi | |
|---|---|
| Löytäjä |
Antoine Lavoisier (en) |
Kuten edellisessä kappaleessa opittiin, erilaisia alkuaineita on noin sata ja niille kaikille on oma kemiallinen merkki. Alkuaineiden yhteydessä puhutaan usein myös atomeista, joihin perehdytään tarkemmin kurssin loppuosassa. Tässä vaiheessa riittää, kun tietää, että atomin rakenne on kaikille alkuaineille erilainen. Rauta-atomi on siis rakenteeltaan erilainen kuin vaikkapa hiiliatomi. Oppikirjoissa atomi kuvataan yleensä pallona. Molekyylimalleissa esimerkiksi vesi koostuu kolmesta yhteenliittyneestä pallosta; kahdesta vety- ja yhdestä happiatomista.
Molekyyli koostuu yhteenliittyneistä atomeista. Molekyylissä on vähintään kaksi atomia liittyneenä yhteen. Yksinkertaisimpia molekyylejä ovat alkuainemolekyylit, kuten vetymolekyyli (H2) tai happimolekyyli (O2). Vetymolekyyli koostuu kahdesta yhteenliittyneestä vetyatomista ja happimolekyyli kahdesta yhteenliittyneestä happiatomista.

Happimolekyyli koostuu kahdesta yhteenliittyneestä happiatomista. Kyseessä ei ole yhdiste, sillä yhdiste koostuu vähintään kahdesta erilaisesta alkuaineesta. Kyseessä on niin sanottu alkuainemolekyyli.
Usein molekyyleissä on yhteenliittyneinä eri alkuaineiden atomeja, kuten vaikkapa hiilidioksidissa (CO2). Hiilidioksidi koostuu yhdestä hiiliatomista ja kahdesta happiatomista. Molekyylien koko voi kasvaa todella suureksi ja isoissa molekyyleissä voi olla yhteenliittyneenä tuhansia atomeja. Molekyylejä, joissa on yhteenliittyneenä vähintään kaksi eri atomia, kutsutaan molekyyliyhdisteiksi.

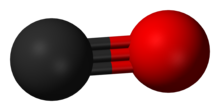
Hiilimonoksidimolekyyli eli häkä koostuu yhdestä hiili- ja yhdestä happiatomista. Hiilimonoksidimolekyyli on yhdiste, sillä siinä on yhdistyneenä kahta eri alkuainetta. Koska kyseessä on molekyyli, voidaan häkää kutsua myös molekyyliyhdisteeksi.
![]() Katso Opetus.tv sivuilta video: Alkuaine, yhdiste ja molekyyli http://opetus.tv/ylakoulu/kemian-mikromaailma/kemialliset-merkit/
Katso Opetus.tv sivuilta video: Alkuaine, yhdiste ja molekyyli http://opetus.tv/ylakoulu/kemian-mikromaailma/kemialliset-merkit/
H04 Alkuaine, yhdiste ja molekyyli
[muokkaa | muokkaa wikitekstiä]- Mikä ero on atomilla ja molekyylillä? (molekyyli koostuu yhteenliittyneistä atomeista)
- Selitä, mitä tarkoittaa yhdiste. (Yhdisteessä on yhteenliittyneenä vähintään kaksi erilaista atomia)
- Mikä ero on alkuainemolekyylillä ja molekyyliyhdisteellä? (Alkuainemolekyyli koostuu yhdestä alkuaineesta ja molekyyliyhdisteessä on yhteenliittyneenä vähintään kahta erilaista alkuainetta.)
A04 Alkuaine, yhdiste ja molekyyli
[muokkaa | muokkaa wikitekstiä]- Mitkä seuraavista aineista ovat molekyylejä: H2, O2 , C, CO2, Au, Hg? (H2 , O2 , CO2)
- Anna esimerkki alkuaineatomista. Kemiallinen merkki riittää. (Na, C, O, Zn...)
- Mitkä seuraavista aineista ovat yhdisteitä: H2, O2, C, CO2, Au, Hg? (CO2)
- Anna esimerkki alkuainemolekyylistä. (Esim. H2 tai N2)
- Anna esimerkki molekyyliyhdisteestä. (Esim. CO2, CO)
- Mitä tarkoittaa molekyylimalli? (Malli on yksi tapa kuvata molekyylin rakennetta. Molekyylimalleja on lukuisia erilaisia.)
Alkuainekoostumus
[muokkaa | muokkaa wikitekstiä]Kaikki aine koostuu atomeista. Videossa esitellään kolmen eri systeemin alkuainekoostumukset.

![]() Katso Opetus.tv:n sivuilta video: Alkuainekoostumus http://opetus.tv/ylakoulu/kemian-mikromaailma/alkuainekoostumus/
Katso Opetus.tv:n sivuilta video: Alkuainekoostumus http://opetus.tv/ylakoulu/kemian-mikromaailma/alkuainekoostumus/
H05 Alkuainekoostumus
[muokkaa | muokkaa wikitekstiä]- Mitkä ovat maapallon yleisimmät alkuaineet? (rauta (Fe) ja happi (O))
- Tässä blogi-tekstissä esitellään ihmiskehon alkuainekoostumus. Lue teksti ja vastaa, mistä alkuaineista proteiinit, hiilihydraatit ja rasvat koostuvat. (hiili, vety, happi, typpi, (rikki))
A05 Alkuainekoostumus
[muokkaa | muokkaa wikitekstiä]- Mistä kahdesta alkuaineesta ilmakehä pääosin koostuu? (hapesta ja typestä)
- Mitkä ovat kolme yleisintä alkuainetta ihmiskehossa? (happi, hiili ja vety)
Varoitusmerkit
[muokkaa | muokkaa wikitekstiä]Kemian luokassa jo yläkoulussa käsitellään lukuisia erilaisia kemikaaleja. Kemikaaleja käsiteltäessä täytyy kiinnittää aina huomiota työturvallisuuteen, kuten rauhalliseen liikkumiseen laboratoriossa sekä silmien ja vaatteiden suojaamiseen. Kemikaalipurkeista löytyy erilaisia merkintöjä, jotka antavat käyttäjälle tietoa kemikaalin ominaisuuksista. Katso video ja tutustu varoitusmerkkeihin.
![]() Katso Opetus.tv:n sivuilta video: Varoitusmerkit http://opetus.tv/ylakoulu/kemian-mikromaailma/varoitusmerkit/
Katso Opetus.tv:n sivuilta video: Varoitusmerkit http://opetus.tv/ylakoulu/kemian-mikromaailma/varoitusmerkit/

Aineiden erotusmenetelmät
[muokkaa | muokkaa wikitekstiä]Erotusmenetelmät
[muokkaa | muokkaa wikitekstiä]Erilaisilla erotusmenetelmillä pyritään erottamaan aineita seoksista. Aineiden erottamiseen käytetään apuna esimerkiksi niiden erilaista kokoa, kiehumispistettä ja liukoisuutta. Arkielämässä käytämme huomaamatta useita erotusmenetelmiä. Eräs esimerkki arkielämän erotusmenetelmästä on pesukone. Pesukoneen rumpu pyörii noin tuhat kierrosta minuutissa ja liike irrottaa veden pyykeistä.

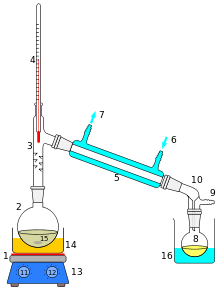
Tislaus
[muokkaa | muokkaa wikitekstiä]Tislaus on hyvin vanha ja edelleen paljon käytetty erotusmenetelmä, jolla toisiinsa sekoittuneita nesteitä voidaan erottaa. Seoksessa olevien nesteiden kiehumispisteet (kp) täytyy erota toisistaan, jotta erottaminen tislaamalla on mahdollista.
Esimerkiksi raakaöljy on seos, joka koostuu lukuisista erilaisista toisiinsa sekoittuneista yhdisteistä. Eri yhdisteet tai yhdisteryhmät voidaan erottaa raakaöljystä tislaamalla. Öljynjalostamossa raakaöljyä kuumennetaan tislauskolvissa ja tislautuessa se aine, jonka kiehumispiste on matalin, höyrystyy ensimmäiseksi. Höyry ohjataan erilleen muusta seoksesta ja jäähdytetään, jolloin se muuttuu takaisin nesteeksi. Puhdas neste ohjataan keräysastiaan. Näin raakaöljystä saadaan erotettu vaikkapa bensiini.
![]() Katso Opetus.tv:n sivuilta video: Tislaus http://opetus.tv/ylakoulu/aineiden-erotusmenetelmat/tislaus/
Katso Opetus.tv:n sivuilta video: Tislaus http://opetus.tv/ylakoulu/aineiden-erotusmenetelmat/tislaus/
H06 Tislaus
[muokkaa | muokkaa wikitekstiä]- Mitä osia tislauslaitteistoon kuuluu? (poltin, tislauskolvi, lämpömittari, kiehumakivet, jäähdytin, keräysastia)
- Mitä tarkoittavat kemian ja fysiikan kirjoissa usein toistuvat lyhenteet kp ja sp? (kp = kiehumispiste ja sp = sulamispiste)
- Etsi verkosta kiehumispisteet vedelle ja etanolille (alkoholi alkoholijuomissa). (vesi = 100 celsiusta ja etanoli = 78 celsiusta)
- Kumpi aineista vesi vai etanoli höyrystyy ensimmäisenä, kun vesi-etanoliseosta (vaikkapa punaviiniä) kuumennetaan tislauskolvissa? (Etanoli, koska sen kiehumispiste on matalampi kuin veden.)
A06 Tislaus
[muokkaa | muokkaa wikitekstiä]- Mitä turvatekijöitä tislauksessa on huomioitava? (Kiehumakivet, ettei tislattava neste pääse ylikuumenemaan. Laitteistosta ei saa rakentaa täysin suljettua systeemiä. Suljetussa laitteistossa paine nousee ja syntyy räjähdysvaara)
- Mainitse teollisuudesta esimerkkejä (vähintään 2 kpl), joissa tislausta käytetään. (esim. vahvojen alkoholijuomien valmistus ja öljynjalostus.)
- Mihin tislaus erotusmenetelmänä perustuu? (Tislaus perustuu eri aineiden erilaisille kiehumispisteille)
Haihdutus ja suodatus
[muokkaa | muokkaa wikitekstiä]
Haihdutusta ja suodatusta käytetään erotusmenetelmänä useissa arkipäivän askareissa; kahvi suodatetaan suodatinpussilla, hengityssuojain erottaa ilmasta epäpuhtaudet ja vesi erotetaan valmiista pastasta siivilällä. Haihdutus tulee vastaan mm. pyykkien ja astioiden kuivaamisessa.
![]() Katso Opetus.tv:n sivuilta video: Haihdutus ja suodatus http://opetus.tv/ylakoulu/aineiden-erotusmenetelmat/haihdutus-ja-suodatus/
Katso Opetus.tv:n sivuilta video: Haihdutus ja suodatus http://opetus.tv/ylakoulu/aineiden-erotusmenetelmat/haihdutus-ja-suodatus/
H07 Haihdutus ja suodatus
[muokkaa | muokkaa wikitekstiä]- Mihin haihdutus perustuu? (Eri aineiden erilaiselle haihtumiselle)
- Mihin suodatus perustuu? (Eri aineiden erilaiseen hiukkaskokoon)
A07 Haihdutus ja suodatus
[muokkaa | muokkaa wikitekstiä]- Mihin suodatusta käytetään? (hengityssuojain, suodattaminen suodatinpaperilla, filtteri savukkeissa)
- Mihin haihdutusta käytetään erotusmenetelmänä? (esim. suolan valmistus merivedestä, pyykkien kuivaus)
- Miten erotat toisistaan a) ruokasuolan hiekan seasta b) rautajauheen hiekan seasta c) haitalliset epäpuhtaudet huoneilmasta? ( a. Ensiksi seos liuotetaan veteen. Tämän jälkeen tehdään suodatus. Hiekka jää suodatinpaperille. Tämän jälkeen jäljellä on suolavesiliuos. Liuoksesta voidaan vesi joko haihduttaa tai tislata erilleen. Näin haidutusastian tai tislauskolvin pohjalle jää suola. b. Rautajauhe saadaan erilleen hiekasta hyödyntämällä raudan magneettisuutta. Hiekka ei ole magneettista. Rautajauhe tarttuu magneettiin. c. Ilmansuodattimella. Epäpuhtaudet jäävät suodattimeen.)
Uuttaminen
[muokkaa | muokkaa wikitekstiä]
Haihdutuksen ja suodatuksen lisäksi myös uuttamista käytetään päivittäisissä askareissa. Esimerkiksi kahvi ja tee uutetaan kuumaan veteen. Uuttaminen erotusmenetelmänä perustuukin erotettavien aineiden erilaiseen liukoisuuteen. Teetä valmistettaessa teelehdistä uuttuu kuumaan veteen vesiliukoisia yhdisteitä, jotka värjäävät veden ja antavat sille teen maku- ja hajuaromit.
Uuttamisen yhteydessä aineet luokitellaan usein vesi- ja rasvaliukoisiin. Vesiliukoiset aineet liukenevat veteen, mutta eivät vaikkapa ruokaöljyyn.
![]() Katso Opetus.tv:n sivuilta video: Uuttaminen http://opetus.tv/ylakoulu/aineiden-erotusmenetelmat/uuttaminen/
Katso Opetus.tv:n sivuilta video: Uuttaminen http://opetus.tv/ylakoulu/aineiden-erotusmenetelmat/uuttaminen/
H08 Uuttaminen
[muokkaa | muokkaa wikitekstiä]- Mihin uuttaminen erotusmenetelmänä perustuu? (Eri aineiden erilaiseen liukoisuuteen)
A08 Uuttaminen
[muokkaa | muokkaa wikitekstiä]- Mihin uuttamista käytetään? (esim. kahvin ja teen valmistus sekä lukuisissa teollisuuden prosesseissa)
- Mainitse kaksi vesi- ja kaksi rasvaliukoista yhdistettä. (vesiliukoisia: esim. ruokasuola ja sokeri; rasvaliukoisia: esim. A-vitamiini ja ruokaöljy)
Atomi ja atomin rakenne
[muokkaa | muokkaa wikitekstiä]Atomi
[muokkaa | muokkaa wikitekstiä]Tässä osassa tutustutaan tarkemmin käsitteeseen atomi. Ajatus, että kaikki aine koostuu pienen pienistä jakamattomista hiukkasista (atomeista) on esitetty jo Antiikin Kreikassa. Vasta nykyaikainen tiede on kuitenkin pystynyt esittämään todisteet atomien olemassaololle.
![]() Katso Opetus.tv:n sivuilta video: Atomi ja atomin rakenne http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/
Katso Opetus.tv:n sivuilta video: Atomi ja atomin rakenne http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/

Atomin rakenne
[muokkaa | muokkaa wikitekstiä]Nykyisin tiedetään, että atomit voidaan jakaa pienempiin osiin. Atomit koostuvat ytimestä ja sitä ympäröivästä elektronipilvestä. Ytimessä sijaitsevat neutronit ja protonit. Erilaisia alkeishiukkasia atomissa on siis kolme: neutroni, protoni ja elektroni.
Elektronien varaus on negatiivinen (-1), protonien positiivinen (+1) ja neutroneilla nimensä mukaisesti ei ole varausta.
Atomin kokonaisvaraus on aina nolla. Atomilla ei siis ole varausta. Tämä johtuu siitä, että elektronien ja protonien määrä atomissa on aina sama ja näin erimerkkiset varaukset kumoavat toisensa.
![]() Katso Opetus.tv:n sivuilta video: Atomin rakenne http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/atomin-rakenne/
Katso Opetus.tv:n sivuilta video: Atomin rakenne http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/atomin-rakenne/
H09 Atomin rakenne
[muokkaa | muokkaa wikitekstiä]- Kuinka monta erilaista atomia (alkuainetta) on olemassa? (noin sata)
- Mistä kolmesta alkeishiukkasesta atomit koostuvat? (elektroni, protoni, neutroni)
- Mitä alkeishiukkasia on atomin ytimessä? (neutronit ja protonit)
- Mikä on elektronin varaus? (-1)
- Mikä on protonin varaus? (+1)
- Mikä on neutronin varaus? (neutronilla ei ole varausta)
- Mitä tarkoittaa elektronikuori? (elektronit voidaan ajatella ytimen ympärille ns. elektronikuorille)
A09 Atomin rakenne
[muokkaa | muokkaa wikitekstiä]- Mikä on atomin varaus ja miksi? (Atomin varaus on aina nolla. Atomissa on aina sama määrä positiivisia protoneja ja negatiivisia elektroneja. Erimerkkiset varaukset kumoavat toisensa ja atomin varaus on tämän vuoksi nolla.)

Järjestysluku ja massaluku
[muokkaa | muokkaa wikitekstiä]Jaksollinen järjestelmä sisältää paljon tietoa atomeista. Tässä luvussa aloitetaan tarkempi tutustuminen järjestelmään ja opetellaan käyttämään sitä.
Aloitetaan jaksolliseen järjestelmään tutustuminen järjestys- ja massaluvuilla, jotka on määritetty kaikille alkuaineille. Järjestelmässä jokaista atomia vastaa kemiallinen merkki ja merkin alaindeksinä on numero, joka ilmaisee alkuaineen järjestysluvun. 7N tarkoittaa, että typen järjestysluku on seitsemän. Yläindeksinä olevaa lukua kutsutaan massaluvuksi. 14N tarkoittaa, että typen massaluku on 14.
Mitä järjestys- ja massaluku sitten tarkoittavat? Yksinkertaisesti ilmaistuna järjestysluku kertoo, kuinka monta protonia atomin ytimessä on. Kuten yllä todettiin, typen järjestysluku on 7 ja tämä tarkoittaa, että typellä on seitsemän protonia ytimessä.
![]() Katso Opetus.tv:n sivuilta video: Järjestysluku ja massaluku http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/jarjestysluku-ja-massaluku/
Katso Opetus.tv:n sivuilta video: Järjestysluku ja massaluku http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/jarjestysluku-ja-massaluku/
H10 Järjestysluku ja massaluku
[muokkaa | muokkaa wikitekstiä]- Mitä alkuaineen järjestysluku ilmaisee? (järjestysluku kertoo ytimessä olevien protonien määrän)
- Mitä massaluku ilmaisee? (massaluku on ytimessä olevien protonien ja neutronien yhteenlaskettu määrä)
- Kuinka monta protonia on natriumin ytimessä, 11Na (yksitoista protonia)
- Hiilen järjestysluku on kuusi. Kuinka monta protonia on hiiliatomin ytimessä? (kuusi)
A10 Järjestysluku ja massaluku
[muokkaa | muokkaa wikitekstiä]- Natriumin massaluku on 23, 23Na. Kuinka monta neutronia on natriumin ytimessä? (23-11 eli 12)
- Kuinka monta neutronia on kaliumin ytimessä, 39K? (39-19 = 20)
- Radioaktiivisen hiiliatomin ytimessä on kahdeksan neutronia. Mikä on tämän hiiliatomin massaluku? (8 + 6 = 14)
- Mikä on atomin varaus? (atomilla ei ole varausta)
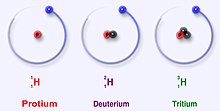
Isotooppi
[muokkaa | muokkaa wikitekstiä]Monilla atomeilla esiintyy erimassaisia muotoja, joita kutsutaan isotoopeiksi. Tietyllä atomilla ytimessä olevien protonien määrä pysyy muuttumattomana, mutta neutronien määrä voi vaihdella. Saman alkuaineen ytimiä, joissa on eri määrä neutroneja, kutsutaan siis isotoopeiksi. Videolla tutustutaan kolmeen hiilen ja vedyn isotooppiin, mutta kaikilla muillakin alkuaineilla esiintyy tällaisia erimassaisia muotoja.
![]() Katso Opetus.tv:n sivuilta video: Isotooppi http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/isotooppi/
Katso Opetus.tv:n sivuilta video: Isotooppi http://opetus.tv/ylakoulu/atomi-ja-atomin-rakenne/isotooppi/
H11 Isotooppi
[muokkaa | muokkaa wikitekstiä]- Minkä nimisiä ovat vedyn kolme isotooppia? (vety-1, deuterium ja tritium)
- Millä tavalla vedyn kolme isotooppia eroavat toisistaan? (isotoopeilla ytimessä olevien neutronien määrä vaihtelee. Vety-1:llä ei ole neutroneja, deuteriumilla on yksi neutroni ja tritiumilla on kaksi neutronia ytimessä)
A11 Isotooppi
[muokkaa | muokkaa wikitekstiä]- Miten radioaktiivisuus liittyy isotooppeihin? (jotkut isotoopit ovat epästabiileja ja hajoavat itsestään. Tällaisia atomeja, jotka muuttuvat toisiksi atomeiksi, kutsutaan radioaktiivisiksi)
- Kuinka monta neutronia on hiili-14-atomin ytimessä? (kahdeksan)
- Kuinka monta isotooppia on vedyllä ja hiilellä? (molemmilla on kolme isotooppia)
- Mitä tarkoitetan raskaalla ja superraskaalla vedellä? Lue [[::fi:w:Raskas_vesi|tämä]] wikipedia-artikkeli aiheesta.
- Typen (N) isotooppeja tunnetaan 16 erilaista. Massaluvut näillä isotoopeilla ovat 10 - 25 (10N, 11N…… 25N). Kuinka monta protonia eri typen isotoopeilla on ytimessä? (Kaikilla on seitsemän protonia. Protonien määrä ei vaihtele isotoopeilla. Ainoastaan neutronien määrä vaihtelee.)
Vesi
[muokkaa | muokkaa wikitekstiä]
Vesi on elämälle välttämätön molekyyli. Ihmisen kehosta noin 60% on vettä. Tarkastellaan tässä kappaleessa vesimolekyyliä (H2O) kemian kannalta. Kuten kaavasta H2O nähdään, vesi koostuu yhdestä happi- ja kahdesta vetyatomista. Molemmat atomeista ovat epämetalleja ja vesi on tämän vuoksi molekyyliyhdiste.
![]() Katso Opetus.tv:n sivuilta video: Yleistä vedestä (yläkoulu) https://opetus.tv/ylakoulu/kemia/veden-kemia/
Katso Opetus.tv:n sivuilta video: Yleistä vedestä (yläkoulu) https://opetus.tv/ylakoulu/kemia/veden-kemia/
Harjoitustehtävä
[muokkaa | muokkaa wikitekstiä]- Kuinka monta prosenttia ihmisen kehosta on vettä? (Vastaus: noin 60 prosenttia)
- Kuinka paljon vettä kuluu farkkujen valmistamiseen? (Vastaus: noin 11 000 litraa)
- Mitkä kolme veden ominaisuutta videolla mainitaan? (Vastaus: hajuton, mauton väritön neste)
Arvioitava
[muokkaa | muokkaa wikitekstiä]Lue wikipedia-artikkeli divetymonoksidihuijauksesta. Mistä tässä jekussa on kyse?
Veden rakenne
[muokkaa | muokkaa wikitekstiä]
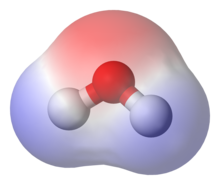
Vesimolekyyliä sanotaan dipoliksi, sillä molekyylissä on kaksi napaa: positiivinen (+) ja negatiivinen (-) napa. Varausten epätasaista jakautumista (dipoleja) esiintyy myös lukuisissa muissa molekyyleissä, kuten vaikkapa sokerimolekyylissä (C6H12O6). Dipolin esiintyminen vesimolekyylissä selittää suurelta osin veden ominaisuudet, kuten vaikkapa veden korkeat kiehumis- (kp.) ja sulamispisteet (sp.) sekä pintajännityksen. Oletko nähnyt kesällä vettä raskaamman vesimittarin (luteita) liikkuvan veden pinnalla? Vesimittarin pysyminen veden pinnalla selittyy veden suurella pintajännityksellä, jonka ansiosta vesimittarin jalkojen alle muodostuu eläintä kannatteleva kalvo. Mitä muuten vesimittarille kävisi, jos veteen lisäisi hieman saippuaa?
![]() Katso Opetus.tv:n sivuilta videot: Veden rakenne (yläkoulu) https://opetus.tv/ylakoulu/kemia/veden-kemia/veden-rakenne/
Katso Opetus.tv:n sivuilta videot: Veden rakenne (yläkoulu) https://opetus.tv/ylakoulu/kemia/veden-kemia/veden-rakenne/
Harjoitustehtävä
[muokkaa | muokkaa wikitekstiä]- Miksi happi saa vesimolekyylissä negatiivisen varauksen? (happiatomi vetää negatiivisia elektroneja puoleensa voimakkaammin kuin vetyatomit. Negatiivinen varaus keskittyy siis happiatomin puolelle molekyylissä.)
- Mitä tarkoittaa dipoli? (Dipoli tarkoittaa yksinkertaisesti kaksinapaisuutta. Toinen navoista on positiivinen ja toinen negatiivinen.)
Veden ominaisuudet
[muokkaa | muokkaa wikitekstiä]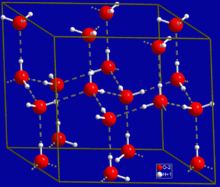
![]() Katso Opetus.tv:n sivuilta videot: Veden ominaisuudet (yläkoulu) https://opetus.tv/ylakoulu/kemia/veden-kemia/veden-ominaisuudet/
Katso Opetus.tv:n sivuilta videot: Veden ominaisuudet (yläkoulu) https://opetus.tv/ylakoulu/kemia/veden-kemia/veden-ominaisuudet/
Videoilla mainittujen ominaisuuksien lisäksi vedellä on myös ominaisuus muodostaa happamia, neutraaleja ja emäksisiä liuoksia.
Harjoitustehtävä
[muokkaa | muokkaa wikitekstiä]- Miksi vedellä on korkea sulamispiste? (Koska vesimolekyylit ovat “tiukasti” kiinni toisissaan vetysidoksilla. Sulamispiste on siis korkea, jos vettä verrataan muihin samankokoisiin molekyyleihin.)
- Mitä pintajännityksellä tarkoitetaan? (Vesimolekyylit ovat kiinni toisissaan ja muodostavat kalvon veden pinnalle.)
- Miksi jää kelluu veden pinnalla? (Koska jään tiheys on pienempi kuin veden tiheys. Vesi siis laajenee jäätyessä.)
- Miksi vedellä on korkea kiehumispiste? (Koska vesimolekyylit ovat “tiukasti” kiinni toisissaan vetysidoksilla. Kiehumispiste on siis korkea, jos vettä verrataan muihin samankokoisiin molekyyleihin.)
Arvioitavat tehtävät
[muokkaa | muokkaa wikitekstiä]- Miksi etanolin (alkoholi alkoholijuomissa) kiehumispiste on alhaisempi kuin veden kp, vaikka etanolin massa on on suurempi kuin veden massa? (Koska vesimolekyylissä on enemmän molekyylejä toisiinsa sitovia vetysidoksia.)
- Miksi vetysidos muodostuu hapen ja vedyn välille? (Erimerkkiset varaukset vetävät toisiaan puoleen. Samanmerkkiset varaukset siis hylkivät toisiaan.)
- Tutustu vesikoulu-verkkosivustoon ja siellä yläkoulun materiaaliin: http://www.vesikoulu.fi/ Verkkosivulla tehtävänäsi on laskea päivittäinen vedenkulutuksesi ja verrata Suomen vedenkulutusta kolmeen muuhun valitsemaasi maahan. Kirjoita lyhyt teksti, jossa vastaat tässä esitettyyn tehtävänantoon.
- Vesijalanjälki -sivulla sinun tehtäväsi on tutustua, kuinka paljon vettä kuluu erilaisten tuotteiden valmistukseen. Valitse kolme tuotetta. Laske myös vesijalanjälkesi ja kirjoita lyhyt teksti, jossa vastaat tässä esitettyyn tehtävänantoon. (Ilmoita siis vedentarve kolmen eri tuotteen valmistukseen + oma vesijalanjälkesi)