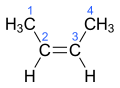Orgaaninen kemia/Isomeria
Isomeria
[muokkaa | muokkaa wikitekstiä]Yhdisteitä, joilla on sama molekyylikaava mutta erilainen molekyylirakenne, sanotaan toistensa isomeereiksi. Rakenteen erilaisuudesta johtuu myös isomeerien toisistaan poikkeavat kemialliset ja fysikaaliset ominaisuudet. Isomeria on erittäin yleistä juuri orgaanisessa kemiassa. Tämä johtuu hiiliatomien taipumuksesta muodostaa ketju- ja rengasrakenteita, σ- ja π-sidosten ominaisuuksista sekä siitä, että erilaisia funktionaalisia ryhmiä on paljon.[1]
Rakenneisomeria
[muokkaa | muokkaa wikitekstiä]Rakenneisomeriassa atomien, sidosten ja funktionaalisten ryhmien paikat vaihtelevat. Tähän lajiin kuuluu runkoisomeria, jossa pitkät hiiliketjut haarautuvat ja rakentuvat eri tavoilla. Paikkaisomeereillä funktionaalinen ryhmä voi sijaita eri paikoissa ketjua, kun taas funktioisomeereillä on sama molekyylikaava, mutta erilaiset funktionaaliset ryhmät.
Runkoisomeria
[muokkaa | muokkaa wikitekstiä]
Runkoisomeriassa eli ketjuisomeriassa molekyylin hiiliketju voi olla haarautunut, haarautumaton tai rengasmainen. Tämä mahdollistaa erilaisten runkoisomeerien esiintymisen. Haarautumatonta muotoa kutsutaan n-muodoksi ja haarautunutta iso-muodoksi. Runkoisomeriaa voi esiintyä lähes kaikilla hiilivedyillä.
Esimerkiksi vieressä kuvattu heksaani ja 2-metyylipentaani (isoheksaani) ovat toistensa runkoisomeerejä. Nämä kaksi yhdistettä eroavat toisistaan muun muassa kiehumispisteen suhteen. Heksaanin molekyylien väliset dispersiovoimat ovat suuremmat kuin muodoltaan pallomaisempien 2-metyylipentaanimolekyylien väliset sidokset, ja siksi heksaanin kiehumispiste on korkeampi kuin 2-metyylipentaanin.
Alla on kuvattuna butaanin mahdolliset isomeerit.
Mahdolliset isomeerit C4 alkaaneille (oikealta vasemmalle): n-butaani ja isobutaani ovat isomeerejä (C4H10); metyylisyklopropaani ja syklobutaani ovat isomeerejä (C4H8); isosyklobutaanille (C4H6) ei ole alkaani-isomeerejä.
| Hiiliatomien lukumäärä | 4 | 5 | 6 | 7 | 8 | 9 | 15 | 20 |
| Isomeerien lukumäärä | 2 | 3 | 5 | 9 | 18 | 35 | 4347 | 366319 |
Paikkaisomeria
[muokkaa | muokkaa wikitekstiä]Toinen rakenneisomerian alalaji on paikkaisomeria. Sitä esiintyy, jos yhdisteessä olevat funktionaaliset ryhmät voivat olla eri paikassa hiiliketjua tai aromaattista rengasta.
Propanolilla on 2 isomeeriä: niiden molempien molekyylikaava on C3H7OH, mutta niiden rakenteessa -OH ryhmä on sitoutuneena eri hiileen. Ne ovat toistensa paikkaisomeerejä.
n-propanoli |
iso-propanoli |

|

|

|

|
Funktioisomeria
[muokkaa | muokkaa wikitekstiä]Kolmas rakenneisomerian alalaji on funktioisomeria. Tämän lajin isomeereillä on sama molekyylikaava, mutta erilaiset funktionaaliset ryhmät.
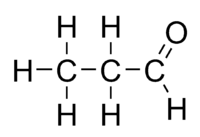
Propanaali ja propanoni ovat toistensa rakenneisomeerejä. Ne kuuluvat eri funktionaalisiin ryhmiin, mutta silti niillä on sama kemiallinen kaava (C3H6O)
propionialdehydi |
asetoni |
|

|
| Funktionaalinen ryhmä: aldehydi | Funktionaalinen ryhmä: ketoni |
Stereoisomeria
[muokkaa | muokkaa wikitekstiä]Stereoisomeriassa eli avaruusisomeriassa atomien keskinäinen sitoutumisjärjestys on aina sama, mutta niiden avaruudellinen suuntautuminen on erilainen. Kun rakenneisomeereillä on yleensä erilaisia kemiallisia ominaisuuksia, käyttäytyvät stereoisomeerit useimmissa kemiallisissa reaktioissa samalla tavalla.
Konformaatioisomeria
[muokkaa | muokkaa wikitekstiä]Cis-trans -isomeria
[muokkaa | muokkaa wikitekstiä]Optinen isomeria
[muokkaa | muokkaa wikitekstiä]
Optisesti aktiivisilla aineilla on kaksi erilaista avaruusrakennetta, jotka ovat toistensa peilikuvia eli enantiomeerejä. Optisille isomeereille on tunnusomaista kiraalisuus eli molekyylin epäsymmetrisyys, jolloin yhdisteessä on vähintään yksi kiraliakeskus, yleensä hiili, johon on liittyneenä neljä erilaista atomia tai atomiryhmää. Tämä on optisesti aktiivinen, jolloin eri enantiomeerit kiertävät polaroitua valoa joko oikealle tai vasemmalle.
Enantiomeerit ovat monilta ominaisuuksiltaan identtisiä. Ne eroavat kuitenkin toisistaan optisen aktiivisuuden suhteen, sillä parin toinen jäsen on vasemmalle ja toinen oikealle kiertävä.
Monet elollisessa luonnossa tapahtuvat synteesit ovat stereospesifisiä, jolloin tuotteena on vain yhtä enantiomeeriä. Sen sijaan tavallinen laboratoriossa tehty synteesi tuottaa ns. raseemisen seoksen eli tuotteen, jossa on kumpaakin enantiomeeriä yhtä paljon.
Noin 80% lääkeaineista koostuu kahdesta erilaisesta enantiomeeristä. Näistä useimmiten vain toisella on kyky sitoutua kohdemolekyyliin. Usein vain toisella enantiomeerillä on lääkeaineen haluttu vaikutus. Toinen enantiomeereistä ei joko vaikuta ollenkaan, vaikuttaa vähäisissä määrin tai vaikuttaa epäsuotuistasti haluttuun kohteeseen. Myös esim. hajuvesissä huomataan eri enantiomeerien vaikutus, sillä usen vain toinen enantiomeereistä tuoksuu hyvältä ja toinen joko tuoksuu vähäisissä määrin, ei ollenkaan tai saattaa tuoksua jopa pahalta.
Vuonna 1953 valmistettiin ensimmäistä kertaa talidomidi-niminen lääkeaine. Sitä käytettiin laajalti 50- ja 60- lukujen välillä mm. uni- ja rauhoittavana lääkkeenä sekä myös ehkäisemään raskausajan pahoinvointia. Talidomidi tuli nopeasti suosituksi, sillä toisin kuin aikansa käytetyimmät unilääkkeet, barbituraatit, se ei aiheuttanut riippuvuutta eikä se myöskään ollut myrkyllistä suurinakaan annoksina. Myöhemmin havaittiin, että sillä oli syntymättömän lapsen kannalta kohtalokkaita sivuvaikutuksia. Jos naiset ottivat lääkettä 3.-8. raskausviikolla häiritsi se tuolloin kehittyvien elinten muodostumista ja mm. vauvojen käsien ja jalkojen pitkät luut olivat lyhyitä tai puuttuivat kokonaan. Vuonna 1961 se poistettiin myynnistä sikiövaurioita aiheuttavana lääkkeenä. Myöhemmin on selvinnyt että talidomidin toinen enantiomeereistä, S -muoto on sikiövaurioiden syynä, kun saman aikaisesti R -muoto ehkäisee pahoinvointia.[3]
Enantiomeerien raseemista seosta ei voida käyttää lääkkeenä mikäli toisella komponentilla on vakavia sivuvaikutuksia. Esimerkkinä mainittakoon eräs tuberkuloosilääke, jonka toinen komponentti parantaa tuberkuloosia mutta toinen komponentti aiheuttaa sokeutta. Nykyisin lääketeollisuus pystyy yhä useammin ratkaisemaan tämäntyyppiset ongelmat niin, että lääke sisältää vain toista enantiomeeriä. Useimmiten kiraalisen katalyytin avulla.
Nimeäminen
[muokkaa | muokkaa wikitekstiä]Enantiomeeri voidaan nimetä sen mukaan mihin suuntaan se kääntää tasopolaroitua valoa. Mikäli se kiertää valoa myötäpäivään, enantiomeeriä merkitään + :lla tai d:llä = dextrorotatory " myötäpäivään" ja vastapäivään kiertävää - :lla ja l:llä = levorotatory " vastapäivään". Enantiomeerin absoluuttinen konfiguraatio voidaan ilmaista R,S-nimeämissysteemin avulla, jolla ei ole mitään yksiselitteistä yhteyttä + / - -kiertosuuntien välillä.

Konfiguraatiolla tarkoitetaan kiraliakeskukseen liittyneiden ryhmien suuntautumista ja se voidaan ilmaista R,S-nimeämissysteemin avulla (R latinan sanasta Rectus " oikea", S = Sinister "vasen").
Molekyylien absoluuttinen konfiguraatio määritetään seuraavasti:
- Kiraaliseen hiiliatomiin liittyvät atomit tai atomiryhmät asetetaan prioriteettijärjestyksen mukaiseen järjestykseen. Järjestysnumerot katsotaan suoraan jaksollisesta järjestelmästä. Mikäli kyseessä on atomiryhmä, niin otetaan atomien järjestyslukujen summa.
- Molekyyliä käännetään siten, että prioriteetiltaan pienin atomi tai substituentti tulee katsojasta kauimmaksi (molekyylin taakse).
- Tarkastellaan jäljelle jäävien atomien tai substituenttien prioriteettijärjestystä. Jos kierto kiraalisen atomin ympärillä on pienimmästä suurimpaan myötäpäiväinen, on kysymys R-konfiguraatiosta, jos taas vastapäiväinen, on kysymys S-konfiguraatiosta.
 |
Esimerkki: Viereisessä kuvassa on kaksi kiraalista hiiliatomia (eli kaikki siihen liittyneet atomit ovat erilaisia). Liittyneiden atomien järjestysluvut ovat seuraavat: H = 1, F = 9, Cl = 17, Br = 35.
- Käännetään molekyylit siten, että pienimmän prioriteetin omaava atomi on molekyylin takana. Tässä tapauksessa se on vety.
- Katsotaan jäljelle jäävistä kolmesta atomista järjestyslukujen avulla kumpaan suuntaan luvut kasvavat pienimmästä suurimpaan. Jäljelle jäävistä atomeista pienin prioriteetti on fluorilla, toiseksi suurin kloorilla ja suurin bromilla. Vasemmanpuoleisessa atomissa kiertojärjestys on myötäpäivään eli kyseessä on R-konfiguraatio. Oikeassa vastapäivään eli kyseessä on S-konfiguraatio.
R,S-systeemi on vain tapa kuvata rakennetta. Sillä ei ole suoranaista yhteyttä yhdisteiden ominausuuksiin.
Vuonna 1975 saivat John Cornforth ja Vladimir Prelog kemian nobelpalkinnon keksittyään stereokemian R-ja S-konfiguraation eli absoluuttisen konfiguraation määrittämisen.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ Kalkku, Karlmi & Korvenranta: Kide 5, s. 50. , 2000. ISBN 951-1-14732-3.
- ↑ Runko- eli ketjuisomeria Viitattu 24.06.2009. suomi
- ↑ Miia Virtanen ja Katja Virtanen: Lääkekemia Viitattu 24.06.2009. suomi